- صفحه اصلی
- استعلام ایزو
- انواع ایزو
- ایزوهای پرکاربرد
- iso 9001 (سیستم مدیریت کیفیت)
- ISO 14001 (سیستم مدیریت زیست محیطی)
- ISO 45001 (سیستم مدیریت ایمنی و سلامت)
- ISO 10006 (سیستم مدیریت کیفیت پروژه)
- ISI 10668 (مدیریت سیستم ارزش گذاری برند)
- ISO 22000 (سیستم مدیریت ویژه مواد غذایی)
- ISO 10004 (سیستم مدیریت رضایت مشتری)
- ISO 10002 (سیستم مدیریت مشتری مداری)
- ISO 21001 (سیستم مدیریت مراکز آموزشی)
- ایزوهای اجباری
- ISO 13485 (سیستم مدیریت تجهیزات پزشکی)
- ISO 15189 (سیستم مدیریت آزمایشگاه طبی)
- ایزو ۲۹۹۹۰ (استاندارد ایزو کیفیت آموزش)
- ایزو ۱۰۰۱۵ (استاندارد ایزو آموزش سازمان ها)
- ایزو ۵۰۰۰۱ (استاندارد ایزو مدیریت انرژی)
- ایزو ۱۷۰۲۵ (استاندارد ایزو آزمایشگاه صنعتی)
- ایزو ۲۷۰۰۱ (استاندارد ایزو امنیت اطلاعات)
- ایزو ۲۱۵۰۰ (استاندارد ایزو مدیریت پروژه)
- ۴۵۰۰۱ ISO(استاندارد ایمنی و سلامت حرفه ای)
- ایزوهای صادراتی
- ایزو تخصصی
- ایزو BFQM
- ایزوهای پرکاربرد
- فرم درخواست ایزو
- ایزو براساس زمینه فعالیت
- محصولات
- خدمات
- آموزش
- خبر و رزومه
- اعطای نمایندگی
- صفحه اصلی
- استعلام ایزو
- انواع ایزو
- ایزوهای پرکاربرد
- iso 9001 (سیستم مدیریت کیفیت)
- ISO 14001 (سیستم مدیریت زیست محیطی)
- ISO 45001 (سیستم مدیریت ایمنی و سلامت)
- ISO 10006 (سیستم مدیریت کیفیت پروژه)
- ISI 10668 (مدیریت سیستم ارزش گذاری برند)
- ISO 22000 (سیستم مدیریت ویژه مواد غذایی)
- ISO 10004 (سیستم مدیریت رضایت مشتری)
- ISO 10002 (سیستم مدیریت مشتری مداری)
- ISO 21001 (سیستم مدیریت مراکز آموزشی)
- ایزوهای اجباری
- ISO 13485 (سیستم مدیریت تجهیزات پزشکی)
- ISO 15189 (سیستم مدیریت آزمایشگاه طبی)
- ایزو ۲۹۹۹۰ (استاندارد ایزو کیفیت آموزش)
- ایزو ۱۰۰۱۵ (استاندارد ایزو آموزش سازمان ها)
- ایزو ۵۰۰۰۱ (استاندارد ایزو مدیریت انرژی)
- ایزو ۱۷۰۲۵ (استاندارد ایزو آزمایشگاه صنعتی)
- ایزو ۲۷۰۰۱ (استاندارد ایزو امنیت اطلاعات)
- ایزو ۲۱۵۰۰ (استاندارد ایزو مدیریت پروژه)
- ۴۵۰۰۱ ISO(استاندارد ایمنی و سلامت حرفه ای)
- ایزوهای صادراتی
- ایزو تخصصی
- ایزو BFQM
- ایزوهای پرکاربرد
- فرم درخواست ایزو
- ایزو براساس زمینه فعالیت
- محصولات
- خدمات
- آموزش
- خبر و رزومه
- اعطای نمایندگی
کپی رایت © 2026


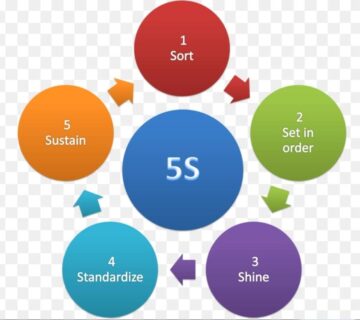
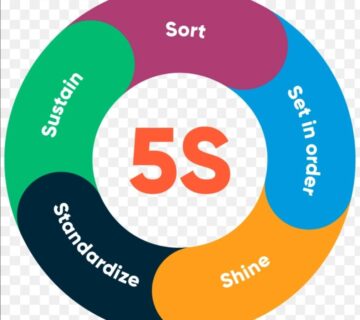
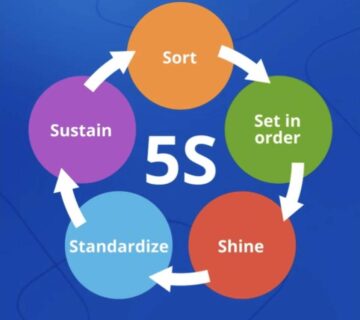
بدون دیدگاه